编者按:
科研实验室管理的信息化,包括科研项目管理,实验设计,实验记录,实验过程及资源管理,文件管理等等,对应的实验室信息管理系统必须合法合规,同时也要易于使用。本文围绕生物医药领域科研实验室信息管理的核心软件ELN(电子实验记录本),探讨一款优秀的ELN应该具备怎样的特质。
1、 ELN的基本概念
1.1、 基本概念
ELN英文名称为Electronic Lab Notebook,或Electronic Laboratory Notebook,缩写为ELN。中文名称为电子实验记录本,又名为电子实验室笔记本。
根据美国“合作型电子记录系统协会”(CENSA)定义,电子实验记录本为“满足法律、法规、技术和科学专业性要求,用于创建、存储、检索和共享数据的电子实验记录系统”。
ELN的主要作用一是能记录实验过程中的关键信息,以为将来能重复实验提供参考与对比数据,二是避免对失败的实验进行不必要的重复,并在当前的基础上进行总结以推进研究的进展。所以,ELN必须能最大程度地保证实验过程中的数据完整性。传统的实验记录都是纸质的,通过笔写记录,这种方式虽便于携带,易于使用,但却不易保管和保存,同时在记录过程中缺乏统一的规范和审核,每个人的记录都会带有很强的个人习惯,包括个人的笔迹,书写潦草程度,都会使记录的数据完整性受到很大的影响,从而影响对整个实验结果的评价。如今,计算机在现代药物研发进程中的应用已经相当普及,许多需要记录的最原始数据都来源于计算机,而将这些数据手动誊抄到纸质的记录本上很容易出错,特殊情况下,如许多分析数据(光谱,色谱,图像等)的誊抄是不可能实现的,只能打印出来。
本文所讲述的ELN,针对生物医药行业。在IND临床试验申报环节,药监局整个过程需要审核的纸质材料厚度甚至比普通人身高还要高,这也是审核工作繁重,审核周期长,效率不高的主要原因。到目前为止,纸质版本的实验记录已越来越影响实验分析和IND临床试验申报审核的效率,特别是当面临高通量筛选和组合化学合成等产生大量数据的实验,或者多个子项目并行开展的情况下,笔写的工作负担和后期的数据统计分析将非常繁重。
1.2、 价值体现
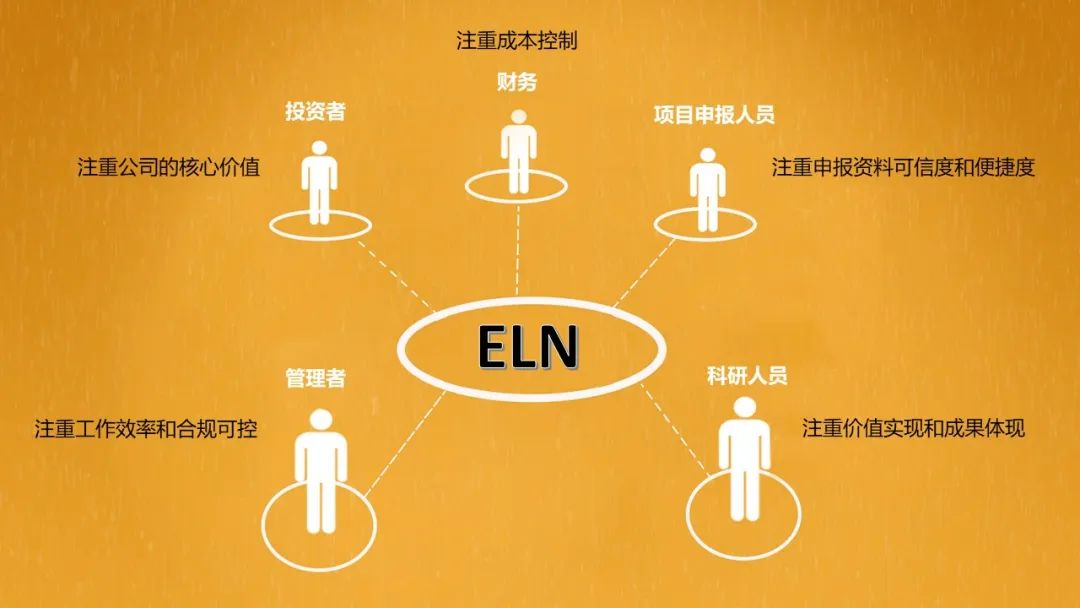
ELN对于科研实验室的价值,不同的角色有着不同的关注点。
投资者
风险评估:信息化程度高的科研机构,价值高,同时风险相对较小,更易受到投资者的青睐。
财务
成本管控:结合物料的耗用统计,实验过程成本控制更具有优势;
项目绩效:结合电子化数据,更易对投入产出进行可视化分析。
管理者
质量管理:更易辅助QA实现审核和质量管理;
信息安全:比纸质记录更易管控数据安全,防止研究数据丢失和恶意传播;
工作效率:传统研发过程重复记录多,不易协作,效率低下;
合规管理:可以有效的规范记录过程、持续合规和有效记录;
审计追踪:电子化记录比纸质记录更易回溯实验过程。
科研人员
价值实现:减少无谓的重复记录工作,专注于实验过程;
成果体现:科研成果更易可视化的直观体现;
查阅方便:更便捷的查阅历史记录及相关。
IND申报人员
减轻工作:纸质申报材料整理工作异常繁杂,更易出错;
便捷审批:药监部门更倾向于电子化便捷审批、提高审批效率;
可信度高:电子化记录可以通过技术手段保证可信度,造假难度高。
各个角色的关注点可总结成一张图:
1.3、 遵循规范
建议遵循如下规范和指南(包括且不限于):
ALCOA+CCEA原则;
FDA 21 CFR Part11,电子签名规范;
GLP ,药物非临床研究质量管理规范(Good Laboratory Practice);
GAMP5,良好的自动化生产实践指南。>>细胞行业应用软件开发实践-GAMP篇
2、 ALCOA+CCEA原则
数据完整性的要求概括起来就是ALCOA+CCEA原则,该原则不仅是GxP对记录完整性的要求,也是所有符合性审核对记录完整性的基本要求。ALCOA+CCEA原则实际上就是对记录生成/录入、修改、存储、检索、备份、恢复和输出等数据生命周期内的所有操作的要求。如果这些操作满足了以上原则,记录的完整性就满足要求了。
ALCOA原则是美国FDA于2007年在其指导原则《临床研究中使用的计算机化系统》中提出的,而ALCOA+原则是欧盟GCP监察官工作组(EU GCPIWG)于2010年在其发布的《关于临床试验中对电子源数据和转录成电子数据收集工具的期望的反馈书》中阐释的。
ALCOA+CCEA原则具体拆解如下:
Attributable(可追溯性):可鉴别采集信息的来源,如受试者、输入者、外源数据等;
Legible(易读性):采集的数据清晰可见,可被他人阅读和理解;
Contemporaneous(同步性):数据应当在产生或观察的当时被同步记录,且在一定的时间窗内输入数据库,即数据的时间性标识;
Original(原始性):数据首次被记录,或可以被追查到原始数据;
Accurate(准确性):数据记录和计算、分析等转换过程与实际操作一致,无主观造假或客观输入错误;
Complete(完整性):所有的数据都存在,无遗漏,如所有检测结果都被保留,包括元数据;
Consistent(一致性):数据没有矛盾或差异,如使用标准化的数据;
Enduring(持久性):数据可被保留所要求的时间长度并可在需要时恢复,如硬盘、CD、磁带等;
Available(可取性):数据在审计时可见,一旦要求,可以及时获取并提供给管理当局。
基于ALCOA+CCEA原则,ELN乃至整个实验室信息管理系统,应该从审计追踪,数据审核,用户权限控制,数据存档,数据备份,文件结构,关系型/非关系型数据库的应用等方面进行设计,以保证数据完整性。
3、 GLP的基本概念
接下来,我们简单介绍下GLP。

基本概念
GLP英文全称为:Good Laboratory Practice,即良好的实验室操作规范。广义上是指严格实验室管理(包括实验室建设、设备和人员条件、各种管理制度和操作规程,以及实验室及其出证资格的认可等)的一整套规章制度。包括对实验设计、操作、记录、报告、监督等整个环节和实验室的规范要求。
GLP最早起源于药品研究。与GCP(药品临床试验规范)和GMP(生产质量管理规范)相对应,药品GLP是指药品非临床(或临床前)研究的质量管理规范。药品的非临床(临床前)研究主要指在实验室进行的安全性毒理学评价和药理、药效学评价(包括药代动力学和毒代动力学研究),故GLP即指从事药品非临床研究的实验室管理规范。
3.1、 GLP的几个组成部分
01 对组织机构和人员的要求
对应的信息系统有人员管理系统。
02 对实验设施、仪器设备和实验材料的要求
对应的信息系统有动物管理系统,设备管理系统,物料管理系统等。
03 标准操作规程(SOP)
SOP通过审批后,可固化到实验室管理系统中,根据业务场景在系统中执行固化的流程。
04 对研究工作实施过程的要求
包括实验方案与实施、实验原始记录和总结报告,对应的信息系统有实验项目管理系统,ELN。ELN虽然只是支撑了GLP规范要求的部分场景,但也是最核心的场景。
05 对档案及其管理工作的要求
对应的信息系统有文件管理系统。
06 实验室资格认证及监督检查
3.2、 GLP的要点
01 标准操作规程
即SOP(Standard Operating Procedures),这是实验室所有人员都必须遵守的操作规范。
02 质量保证部门
即QAU(Quality Assurance Unit),保障SOP执行到位。
03 项目负责人
即SD(Study Director,研究指导者),负责协调科研项目成功实施。
04 动物饲养设施
保障受试物性能良好,安全可信。
05 实验方案与实施、原始记录和总结报告
确保实验过程可靠。
06 实验室资格认证与监督检查
确保实验质量可靠。
3.3、 GLP软件建设的主要内容
01 合乎GLP管理要求
02 合乎研究机构实际情况的标准操作规程(SOP)
4、 ELN的核心设计
最后,咱们又回归到ELN本身的特性来讲述。根据上述对ELN的背景研究,以及对ALCOA+CCEA原则和GLP规范的解读,ELN核心功能可分为如下几块:

4.1、 符合GLP药物非临床研究质量管理规范
其核心就是要保证数据完整性,遵循ALCOA+CCEA原则。主要功能包括:电子签名,追溯审计。
电子签名的主要作用有以下几点:
明确操作主体的身份,可识别其真实性;
表明操作主体认可操作的内容,一旦篡改可被发现;
整个操作过程会被记录,使用电子签名即对数据的完整性、正确性负责。
而追溯审计,指的是系统应记录所有数据生命周期内的操作,包括记录生成/录入、修改、存储、检索、备份、恢复和输出等,并且能根据不同关键词逐层回溯。ELN系统设计中可综合运用系统日志,业务日志,用户权限控制,数据存档,数据备份,文件结构,关系型/非关系型数据库的应用等设计。追溯数据在实验结果分析,IND临床试验申报环节中,都可以作为重要的证据提供。
4.2、 符合IND审核要求的电子文件格式
通过对实验方案与实施、原始记录和总结报告的结构化管理,在实验项目成功结束后,采用eCTD(电子通用技术文档)格式输出申报材料,便于药监部门按标准文件格式审核。
CTD(The Common Technical Document 通用技术文件)是国际公认的文件编写格式,用来制作一个向药品注册机构递交的结构完善的注册申请文件。采用统一的格式将会显著减少企业财力和物力的投入,缩短申请编写的时间,并且将简化电子递交的操作。标准化的文件还有助于注册机构的评审并加强评委同申请人之间的交流。
eCTD 是英文 Electronic Common Technical Document 的简称,eCTD由CTD发展而来,中文名为电子通用技术文档。其作为国际公认的文件编写格式,同样用来制作一个向药品注册机构递交的结构完善的注册申请文件,是由ICH为了解决人用药在申请注册中格式和内容的统一,而决定采用的统一的注册申请文件格式。
随着医药研发的演进,注册文件递交的方式,总共经历了四种变化:
采用快递形式运送大量的纸质文件
将文件做成PDF格式后,用光盘形式提交。但还是存在缺陷,比如数据是非结构化的,在想要建立关联或者进行搜索时很困难
光盘的形式,在数据结构方面比PDF有了提升
包含大量超链接、文件格式等,可帮助做一些格式化的审核
2010年欧盟强制要求集中审批程序使用eCTD申报,2018年起美国强制要求eCTD格式申报。中国制药行业将向全球行业标准看齐,采用eCTD则是中国朝着国际统一迈进的必然之举。目前国家药监局接收的IND申请,都已要求申报企业把申报材料转成eCTD格式。
4.3、 简化实验人员的实验记录操作
不同的实验小组,要求的实验记录方式各不相同,有些实验小组要求小组成员做完一台实验就马上记录,有的则要求做完当天所有实验才统一记录,有的实验室里面没有电脑。这种种场景,就要求我们的ELN系统,必须要尽量简化实验室人员的实验记录操作,让实验人员能有更多的精力去思考实验本身,系统要尽量智能地辅助实验人员的记录工作,如:经典方法,在线富文本编辑器,仪器数据自动获取,语音、视频辅助记录,语音输入识别,图像识别,离线自动保存记录等。同时,还要根据工作场景,考虑多种终端的适配支持,如PC,PAD的支持。
另外,ELN还应能处理各种不同类型的专业数据,例如化学结构,化学反应,实验方法,图像,光谱,色谱,基因序列等,以此分担科研工作者繁杂的演算分析工作。
4.4、 辅助管理者规范实验室管理
一方面,通过ELN,约束实验人员规范记录实验过程,总结实验,做到按时按质完成实验,最终朝着项目目标有序推进。基于这个职责,系统应从易用性、稳定性、安全性等角度综合设计,具体功能不再一一列举。
另一方面,系统开发过程要契合GAMP的指导方法,如计划阶段明确系统目标,进行风险评估(RA),制定详细的URS;设计阶段编制可行的软件设计说明书(DS);整个开发过程都有获得批准的SOP可遵循,最后还要有安装确认(IQ),运行确认(OQ),性能确认(PQ),验证报告(VSR)等。这样的ELN自然能提供合法合规的计算机化系统验证CSV,最重要的是,在这个体系下,计算机化系统整个生命周期可以持续稳定运行直至退役。
总而言之,合法合规,适合行业,适合实验室工作场景的ELN,才是一款优秀的ELN。