![]()
(一)革命性治疗效果的CAT-T需要配套新的生产交付方式,以释放其临床治疗效能
美国FDA自2017年批复首个CAR-T产品上市,到目前已经有6个CAR-T产品在美国上市,适应证包括骨髓瘤、淋巴瘤和白血病等。但具有革命性临床疗效的CAR-T上市后,却遇到一个制药行业前所未有的新问题:生产供应不足,无法满足临床治疗需求。
CAR-T产品的生产是利用嵌合抗原受体(chimeric antigen receptor, CAR)基因将患者的T细胞“变成”清除肿瘤细胞的“杀手”。整个生产过程漫长、复杂而又劳动密集,并且是“单人单份”的个性化生产模式,也就是一个患者就是一个批次的生产方式,无法简单地复制传统制药行业的“兴建厂房”来实现产能的提升与扩大。这是因为细胞治疗与传统的制药行业相比有几个特点,一是原材料的人体化,二是生产批次的个体化,三是终产品的活性化。这些特征就迫使行业需要有能兼容CGT产品这3个特征的生产交付方式。

因此,采用制药行业习以为常的交付方式,CGT产品进入临床后必然会面临供应不足的窘境,临床医生如何决定临床中等待CAR-T治疗的患者的治疗顺序,也就是先为哪一位患者安排生产排期,而另外一些患者则必须等待更长的时间,这对于他们来说可能就意味着失去接受治疗的机会。
2022年的一项研究(Kourelis et al,2022)显示,患者等待CAR-T治疗的时间可能长达几个月。2021年,美国总计有35 000名新增的骨髓瘤患者,MD安德森癌症中心每个月平均有10个新增病例符合接受CAR-T治疗的临床指征,但该中心只有5位患者的治疗名额。5个CAR- T的治疗名额是因为MD安德森癌症中心的规模和声誉,美国境内的其他癌症治疗中心每月能获得的CAR-T治疗名额就更少了。
(二)原材料人体化与生产个性化导致产能无法无限扩展
目前每一个CAR-T产品都需要患者自己的细胞作为生产原料(原料人体化),而且必须在特定的洁净室单独生产(生产个体化),因此要满足临床中每个患者的治疗需求,生产商必须配置足够的产能并且加足马力生产,但每一个CAR-T产品的生产放行时间也需要大约3周的时间。并且生产期间,如果患者病情恶化,那正在生产中的CAR-T产品就会浪费。
此外,这种生产供应不足将随着CAR-T成为二线治疗方案进一步加剧。而导致CAR-T产品生产供应不足的主要原因是,这些个性化的活细胞产品必须在受控的高级别洁净室中由大量训练有素的技术人员手工生产。即便是依据当前制药行业扩大产能的解决方法,通过增加高级别洁净室面积的方式来提升产能,但新设施的建设期也需要数月,甚至是数年的时间建设,招聘或培训符合生产要求的技术人员。例如,资金充裕的公司能在短时间内新增100个洁净室,但却无法在短时间内找到能及时上手操作的合格技术员。
目前,实际运行中的生产交付过程是这样的,也称为静脉到静脉的时间(vein-to-vein time)。临床治疗中心需要评估患者病情是否符合CAR-T治疗,然后采集患者的外周血,并在临床治疗中心将其中的T细胞分离出来,再将分离出的T细胞“快递”到细胞制备中心。在那里,技术人员用几天的时间准备T细胞,并利用病毒载体将CAR转染至T细胞,赋能T细胞能够识别并杀灭肿瘤细胞。之后,技术人员需要几天的时间将转染了CAR的T细胞进行培养扩增获得足够数量的CAR-T细胞。随后,制备中心的质控部门还需要大约7天的时间开展无菌检测、质量保障,以确保终产品符合放行标准,可以回输给患者。最后,将生产合格的CAR-T产品冻存再运回治疗中心。通常,此时患者还需要大约5天的时间做准备,然后才能接受CAR-T细胞的回输。
因此,按照当前的生产交付方式,实际上静脉到静脉的时间需要4—5周,这个时间预期的前提是任何一个环节都顺利推进。整个过程中有任何一个环节发生状况都会导致时间延长至5—8周,甚至是生产失败。
另一个导致CAR-T产品供给不足的原因是,目前用于支持药品生产的工艺和设备可以说已经过时,还是一种手工开放式的生产方式。而现代化的生产要求参与生产的不同部门,包括运营团队、质量团队、临床团队都从生产过程中获得所需要的生产过程数据。这些数据是保障药品安全生产的必要条件。传统药品生产方式能持续至今,是因为许多药品可以大批量生产,数以百万计的药品生产只需一套生产纪录。但CAR-T的生产是个体化的,一批生产就是一个患者剂量,目前完全处于手工状态,是用纸和笔来记录所有的生产数据。
另外,CAR-T产品的许多生产步骤也是手工处理的,与数字系统相比,偏差或出错率会更高。如果生产记录实现电子化、数据化,将生产过程与临床、生产商及承运人等同步共享,CAR-T的总体“静脉到静脉的时间”可能会大幅缩短。从赛动智造的全生命周期溯源软件实际应用案例来看,可以缩短40%的时间,而应用赛动智造的全自动床边制造系统在治疗中心就近生产(point-of-care-manufacturing),总体时间会进一步优化缩短。

因此,目前该行业的主要公司都在寻求自动化生产解决方案,以进一步缩短静脉到静脉的时间。
(三)封闭式、连续性、自动化生产将有效缓解CGT产品的供给不足,并能节省时间和金钱
不仅是CGT产品的生产需要一种更快速、更安全及更有效的方式,药品的生产方式也需要改变。尽管美国FDA数年来一直鼓励医药行业采用更为有效的连续性生产,虽然封闭式、连续性、自动化生产在其他行业已经应用了数十年,但医药行业的生产方式的改变却非常缓慢。
连续性生产是在不间断、封闭集成产线实现药品的生产全过程。与之相对的是,目前行业广泛采用的是批量生产,即按顺序实施不同的步骤完成药品生产。
作为CGT产品封闭式、连续性、自动化生产的先驱,笔者对包括CGT在内的生物医药公司接受这种创新的缓慢速度感到惊讶:一个治病救人并在许多研究领域都走在前列的行业,为什么在生产运营方面却远远落后于其他普通商品行业的平均水平?
当笔者参与赛动智造创建时,CGT沿用制药行业广泛应用的批量生产非常普遍,并认为是理所当然的,生产救命药的设备和产线也不是在其他行业已经普遍使用的最尖端、最先进的系统,而是大量穿着洁净服的技术人员坐在生物安全柜旁边,将戴上手套的手伸进柜里按照标准操作规程(SOP)依次操作,完成生产。这种已经被其他行业淘汰的生产方式意味着CGT生产的效率低下,灵活性较差,通量也较低,并且会受限于质量控制的高要求,容易产生比其他行业更高的批次失败率。这样来看,发生前述的供应不足就不足为奇了。
当赛动智造的团队与细胞公司对接产线部署需求时,基于客户的需求,就能便利地实现赛动智造的封闭式、连续性、自动化产线方案,满足客户的细胞生产需求。2020年初与客户达成共识,最终为客户提供了能满足良好药品生产质量管理规范(GMP)的连续制造生产线,实现一种通用型细胞产品(间充质干细胞产品)的大规模、连续性生产。到了2021年,客户又提出继续设计和部署适用于诱导多能干细胞(iPSC)产品的连续性生产解决方案,这是客户产品线中的主打产品,客户认为赛动智造的封闭式、连续性生产非常适合个体化细胞治疗产品的产能快速扩展以及多样本并行处理的需求。赛动智造的团队其实有一个更大的愿景,即设计的自动化产线能够兼容客户管线中其他个体化细胞产品的生产工艺。
赛动智造为客户设计部署的连续性产线,相较于客户当前使用的人工开放操作的批量生产方式来讲,赛动智造封闭式连续性产线生产过程中对关键原辅料的使用会非常集约高效,极大地降低关键试剂因批次生产量无法匹配试剂包装量而导致的浪费,并能依据客户产能的耗材实际消耗,统筹、规划耗材管理。
封闭式、连续性产线的效率、灵活性、敏捷性和智能质量控制使得“技术密集、操作密集”的CGT生产得以在治疗中心实施,成为临床机构中心药房的延展,围绕着患者需求就近开展“即采、即做、即用”,破解革命性疗效的细胞治疗与临床中大量无法满足的需求之间的矛盾,缓解临床医生面对患者“生与死”的决策压力。

国家级产业化项目“生物技术与信息技术融合应用工程”
(四)美国FDA关于连续性生产的观点
美国FDA早在2019年2月就发布了指导性文件《连续性生产的质量考量》(“Quality Considerations for Continuous Manufacturing”),鼓励行业生产转向连续性生产方式。该指导性文件就申请人如何在新药注册申请、仿制药申请及补充申请材料中解决以连续性生产工艺生产中的质量考量问题提出了建议及科学原理,FDA支持包括生物制剂在内的药品生产商开发采用连续性生产工艺和产线。
FDA认为,连续性生产特别适合突破性治疗(Breakthrough Therapy),包括CGT治疗,FDA制定突破性治疗的初衷是加快临床开发速度,将关键疗法更快地推向市场以挽救更多生命。除了速度和质量的考量,CGT产品采用连续性生产能产生批量生产中无法获取的CMC(chemistry, manufacturing and control,化学、制造与控制)数据,并降低总体生产成本。连续性生产能更充分地将质量源于设计(quality by design)的理念和原则嵌入工艺开发中。
依据FDA的定义[ICH Q8(R2),Pharmaceutical Development],质量源于设计是以系统的开发方法,基于健全的科学和质量风险管理,从定义产品目标开始,强调通过对产品和过程的理解及过程控制,实现产品质量定义。工艺参数在连续性生产中一览无遗,质量控制过程也“变得”容易可行,可以通过对连续性生产“机器”上的“按钮”,依据患者“原材料”的个体特征进行调整参数和比率,并快速采样,以达到终产品的质量目标。同时也使得细胞公司能够快速有效地优化工艺,提升产品质量,同时减少浪费并降低成本。连续生产还提供了立即扩展到商业生产的能力,并且没有手工产线扩大产能时的显著滞后时间。
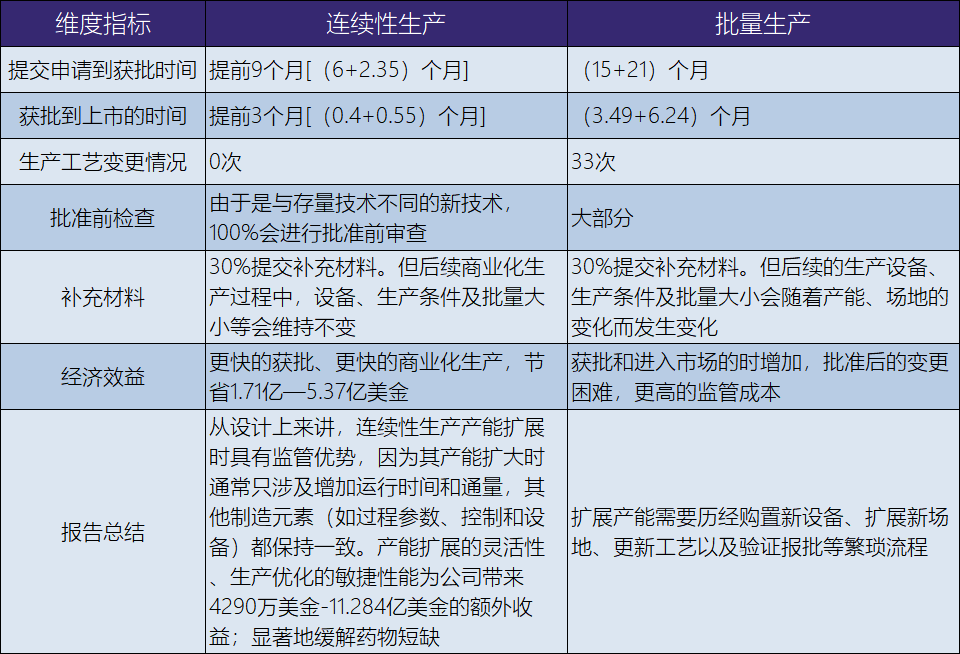
为此,FDA于2022年专门发布关于“FDA对药品连续生产的自我审计”(“An FDA Self-Audit of Continuous Manufacturing for Drug Products ”),与批量生产方式相比,采用封闭式、连续性生产的药物的平均审评审批时间缩短了3个月。详细比较分析见表12-88。
表12-88 连续性生产 VS 批量生产