我们中心专注于为细胞药品创新研究机构及企业提供专业的临床试验CRO服务。我们致力于为客户提供细胞药品的Ⅰ-Ⅳ期临床试验、患者招募与管理、中心实验室、药物警戒、SMO、电子数据管理系统、临床监查、统计分析、注册申报、医学论文撰写等一系列的专业化技术服务与解决方案。
我们将严格遵守《干细胞临床研究管理办法(试行)》和《干细胞制剂质量控制及临床前研究指导原则(试行)》等规定,根据赫尔辛基宣言和ICH-GCP规定进行临床试验。我们同时提供符合FDA 21CFR Part 11、HIPPA、CDISC三项世界公认标准的电子数据采集(EDC)系统,按照NMPA的要求对临床试验全过程进行全面细致化的数据管理。
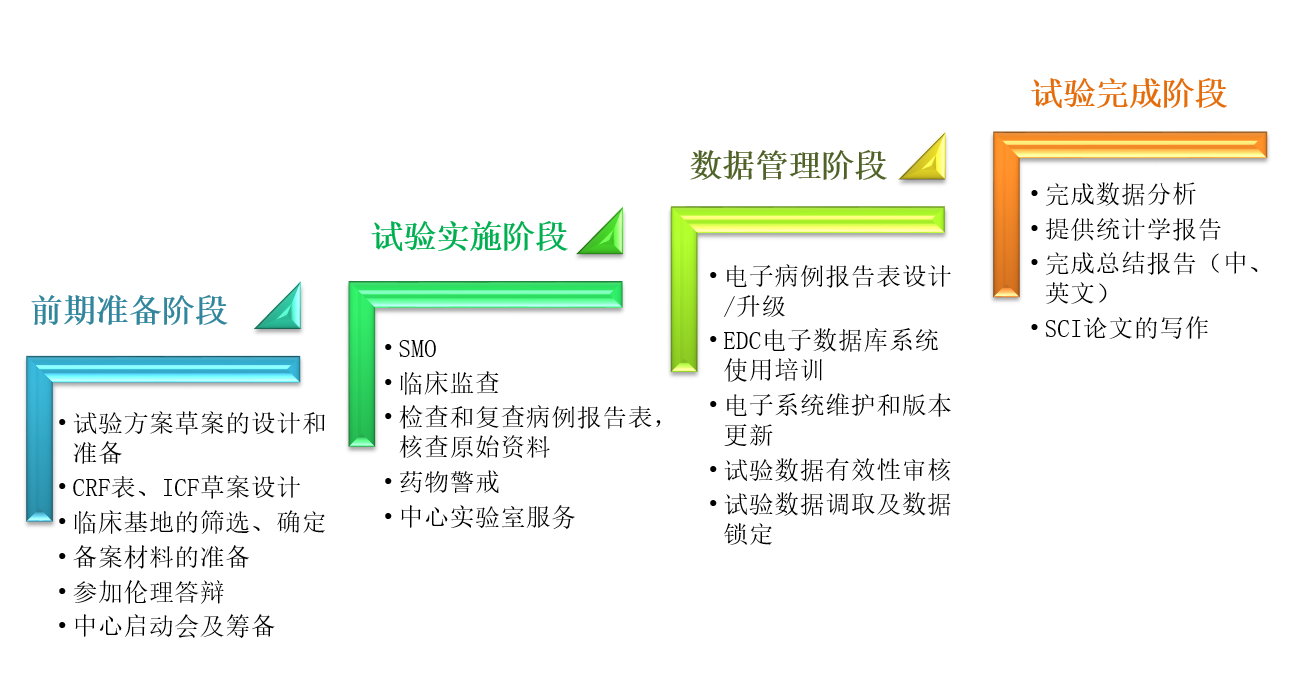

• 负责整体监控临床试验项目的进度及质量,确保项目在规定时间内完成
• 准备伦理委员会申请材料,并确保及时的年度审核,避免项目失效
• 负责与PI及各个研究中心或医院沟通,及时解决日常遇到的问题
• 负责项目相关的纸质文件的管理及归档
• 负责制定临床试验操作相关的SOP,按监查计划对中心进行监查,确保项目的完成质量
• 并对参与临床试验项目的相关人员进行SOP培训,确保参与项目的各个研究中心或医院依照统一的标准开展试验
• 负责组织并具体开展临床试验项目
• 解答与研究相关的问题
• 提供专业医学论文的写作
• 负责临床试验数据的统计分析工作
• 编制统计分析报告
• 配合临床研究部和项目管理部进行试验方案的建立
• 负责电子数据收集系统(EDC)的维护和升级
• 保障数据的安全性,包括数据采集,输入,建立完善的数据格式
• 做到可依据其他部门的要求锁定及输出数据
• 保证数据的精确性和一致性,对不合理的数据与临床及相关人员沟通后,进行修订等
• 负责细胞产品,检测试剂等相关产品的注册申报工作,和药监局相关政府审评机构沟通协调、准备注册申报相关文件并且协调注册的相关流程等
目前我中心与国内三甲医院以及知名生物制药公司在干细胞治疗红斑狼疮、糖尿病、骨关节炎和狼疮性肾炎等领域均有密切合作。我们将提供高质量的研究结果,在尽可能短的时间内实现临床转化和药品上市,为客户创造价值。