![]()
CAR-T治疗在血液肿瘤的治疗中取得了令人瞩目的临床效果,虽然实体瘤的发病率占据了总体肿瘤的大部分,如乳腺癌、肺癌、胰腺癌、卵巢癌、前列腺癌等,但在实体瘤中,细胞治疗仍然存在巨大挑战。CAR-T用于实体瘤治疗的关键挑战在于如何找到一个针对具体肿瘤的特异性标志,并且这种标志物只存在于肿瘤细胞,而不存在于健康组织,尤其是不能存在于如心脏、脑组织等重要脏器组织。 CLDN6有望成为治疗实体瘤的潜在标志物。2022年4月的美国癌症研究协会年会(AACR 2022)上,有公司发布了结合mRNA的CAR-T能有效锚定表达CLDN6的实体瘤,显示其能有效缩小实体肿瘤。该研究认为CLDN6可能是一个治疗实体瘤的有效标志物。 CLDN6是Claudin蛋白质家族的成员之一,参与调节细胞渗透性和黏附性,维持细胞的结构与形状,存在于胎儿发育过程中。肿瘤细胞通常利用激活胚胎基因以获得较强的增殖能力。CLDN6存在于所有的睾丸癌细胞,大部分的卵巢癌、非小细胞肺癌、胃癌、乳腺癌和子宫内膜癌也会表达CLDN6。在一些正常的人体组织如胰腺和肝脏也发现有CLDN6表达,但表达量非常低。从这一点来看,CLDN6是一个较为理想的锚定实体肿瘤的标志物。 过去的几年中,越来越多的公司开始投资CLDN6,并且在公司内部建立CLDN6管线。例如,前述在AACR 2022年会公布早期研究结果的BioNTech(一个著名的疫苗公司)的CLDN6-CAR-T管线和“CLDN6编码mRNA+CAR-T”;Context公司的CLDN6双特异性抗体等。 免疫检查点抑制剂的作用机制是通过阻断关键的免疫细胞“刹车”,使免疫细胞处于“查岗”状态。通过关闭这些“安全系统”,免疫细胞可以自由地行使其天然“职能”,识别并攻击、摧毁身体内的癌细胞。在过去的10年里,科学家们针对PD-1和CTLA-4检查点研制出了非常成功的单抗,并使Keytruda、Opdivo和Yervoy等药物进入临床。 2023年,第三个免疫检查点LAG-3有望获批上市,为肿瘤免疫治疗的“武器库”增添新成员。 LAG是一种淋巴细胞活化基因(lymphocyte activation gene),3是研究人员发现的LAG的序号。LAG-3位于同一染色体上CD4的右侧,两者的基因序列具有相似之处,CD4是辅助性T细胞上的一个关键受体,承担着激活T细胞的作用。LAG-3和CD4都是由4个类似的抗体成分一个接一个地连接在一起,具有惊人的结构相似性,研究发现,LAG-3具有类似的功能,两者互为副本。 人体免疫系统的工作机制有点类似汽车,而免疫检查点分子则类似汽车的刹车系统。汽车有手刹和脚刹,当将脚放在油门上同时松开脚刹,汽车会移动但是速度不会特别快。目前我们发现的3个免疫检查点分子中,LAG-3相当于手刹,而PD-1、CTLA-4是脚刹,单独放开脚刹时汽车会移动,而单独放开手刹,汽车一般不会移动。因此,汽车的引擎发动需要放开更多的刹车。 目前开展的临床试验方案是“LAG-3+PD-1”抑制剂的联合用药治疗黑色素瘤,表现出良好的生存获益,并且不良反应较轻。AACR 2022上公布的研究数据显示,接受联合治疗的黑色素瘤患者平均无进展生存期为10.2个月,是仅接受PD-1抗体治疗的患者无进展生存期的2倍多。同时显示,43.1%的患者对联合治疗有应答,而仅接受PD-1抗体治疗的患者中,32.6%有应答。 基于组合治疗黑色素瘤的成功,LAG-3有望有更多的联合选择用于治疗更多疾病,如肺癌、乳腺癌、肝癌等。 CAR-T在血液肿瘤的治疗中获得了令人瞩目的治疗效果,迄今美国FDA已经批复了6种CAR-T产品上市,用于挽救一线、二线、三线治疗无效的血液肿瘤患者的生命,但CAR-T在实体瘤中的研究却一直不太理想。 新一代更智能的T细胞能克服当前CAR-T无法完成的“职能”。目前已经有科学家正致力于设计新的CAR-T,以用于肺癌、卵巢癌及脑癌等实体瘤的治疗。 一项研究SynNotch-CAR T 细胞克服治疗胶质母细胞瘤的特异性、异质性和持久性的挑战(SynNotch-CAR T cells overcome challenges of specificity, heterogeneity, and persistence in treating glioblastoma)初步显示了CAR-T治疗脑胶质瘤的可能性,通过在细胞内构建合成信号电路在动物模型上显示出良好的有效性。 当前临床中用于血液肿瘤治疗的CAR-T,虽然能够有效识别和锁定癌细胞标志物,但无法有效控制接下来的“超级免疫反应”。于是,研究人员构建了一个名为SynNotch的细胞组分,这是一种横跨T细胞外膜的受体,当它与肿瘤细胞标志物结合时,一小部分会断裂并直奔细胞核,在细胞核中开启或关闭其他基因。SynNotch赋予T细胞一层新的类似电子电路板的生物逻辑。不再是仅仅当癌症特异性抗原存在时进行杀伤,而是可以指导T细胞行使其“职能”,当T细胞探测到癌细胞,并且癌细胞存在于目标器官中,或者当T细胞只探测到癌细胞而没有健康组织时,就可指示T细胞实施杀伤。 研究人员为人类T细胞设计不同版本的SynNotch电路,最终重新设计的SynNotch CAR-T清除了第一代CAR-T无法清除的脑肿瘤,并且不良反应也比较温和,5个月后,实验小鼠仍然没有肿瘤。 将2个自身都存在缺陷的抗原整合到一个电路板上,相当于建立了一个类似的生物系统运行的电路系统,用于疾病的治疗,其中一个分子的特异性太高了,而其他分子的特异性则太广了——不仅在脑癌细胞表达,也会在其他器官中表达,如肝脏和肾脏。如果不加以选择地派遣T细胞前往执行任务,可能会导致健康组织的附带损伤,但新构建的SynNotch的传感器就很好地解决了这一难题,第一个开关就是锁定脑胶质瘤的特异性分子,树立肿瘤的灯塔以引导T细胞,明确“作战半径”。当这个开关激活后,另一个开关就发出信号,引导T细胞攻击“灯塔”周围携带标志物的细胞,共同完成清除胶质瘤细胞的任务,由于“作战区域”的有效界定,不良反应也比较可控。 事实证明,这种组合不只适用于脑肿瘤,本研究作者之一Roybal于2017年更新了SynNotch版本,尝试治疗间皮癌和胰腺癌等,利用工程化的T细胞精准识别并杀灭肿瘤细胞,而不损伤正常组织,同时有效克服了CAR-T治疗较容易出现的T细胞衰竭的问题。 肿瘤治疗,尤其是占据临床主要比例的实体瘤治疗,是一个任重而道远的科学任务与临床目标,需要学界的不断研究探索,临床医生与患者的理解、参与、合作,业界的“点石成金”,不断完善和更新已有的机制和功能数据库,通过合成生物学的方法尝试设计、研究和制造更多复杂的产品,以解决临床中复杂的疾病,推动人类社会更健康、更美好。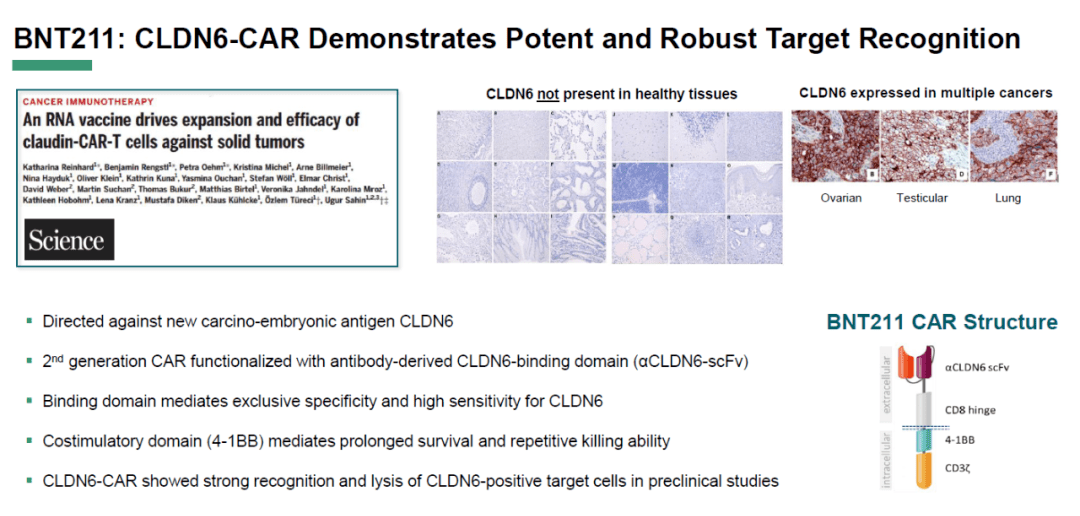
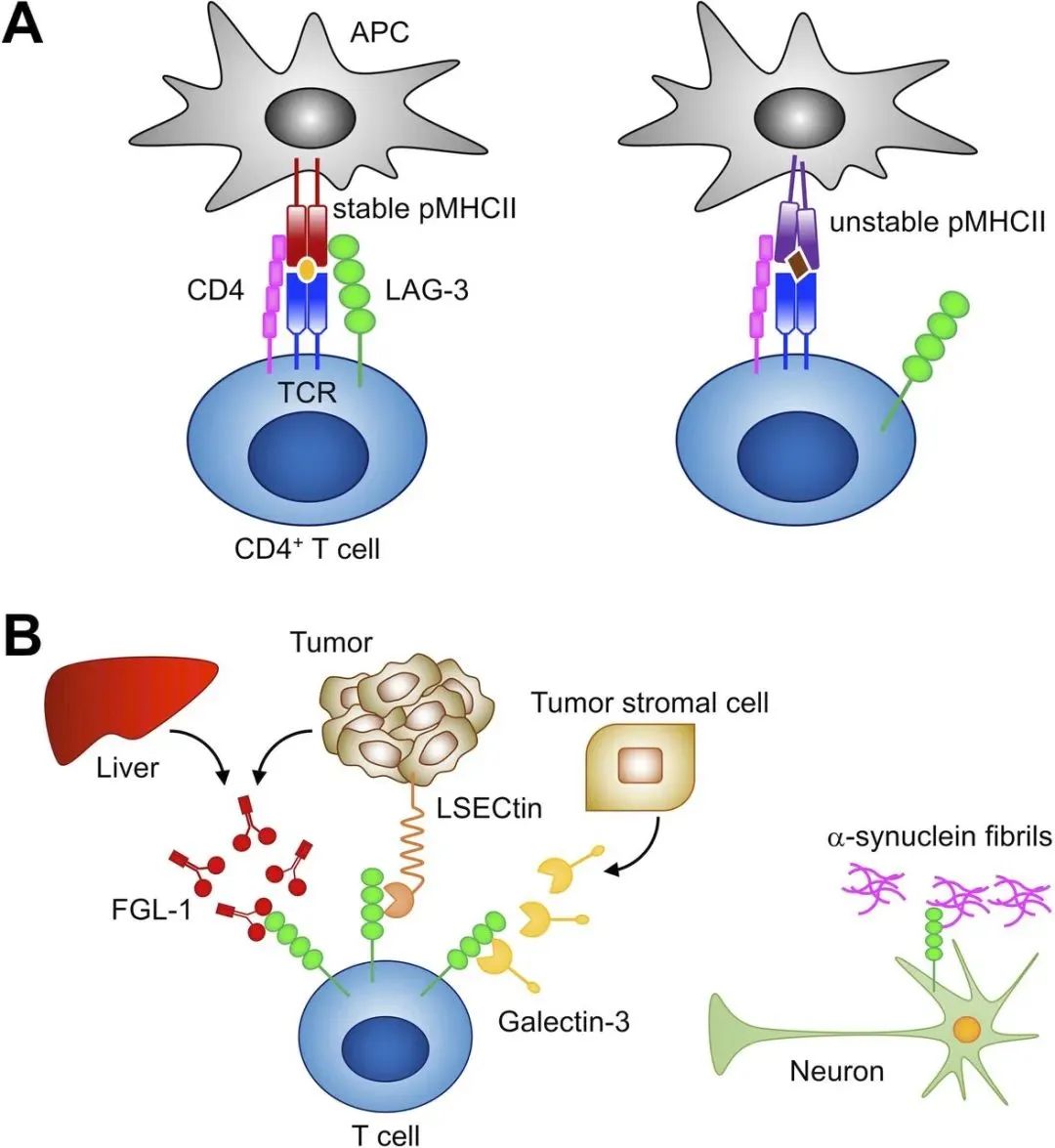
LAG-3的表达和配体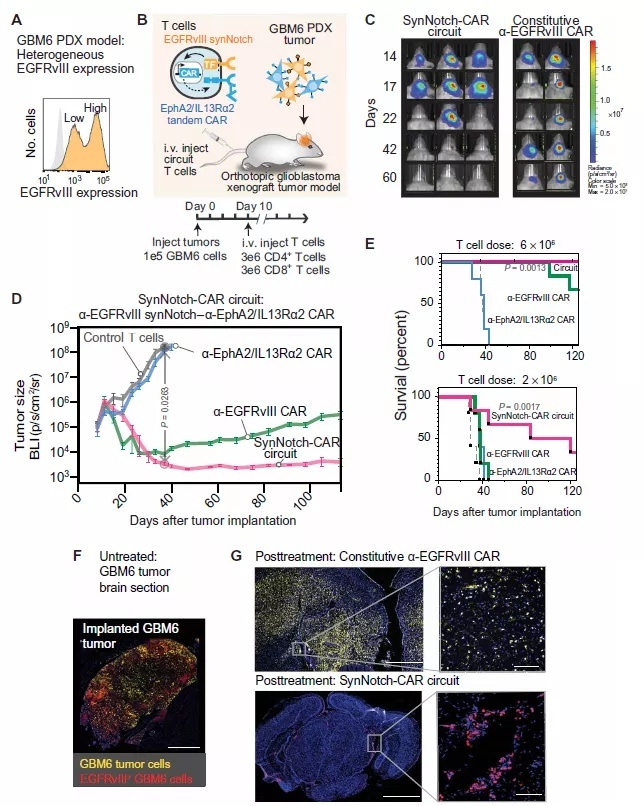
SynNotch-CAR T细胞在清除异质性GBM6 PDX肿瘤方面比传统CAR-T显示出更高的疗疗效和持久性