2019年11月发布的《2019 中国临床医学研究发展报告》中指出中国的临床医学研究论文数量增长迅速,数量占全球总数的比重从2009年的5.06%增至2018年的13.57%,位居全球第二。该报告同时指出,数量增长的同时,需要进一步加大对医学论文质量的提升,从而提高我国的医学研究的国际影响力。
医学论文质量的好坏,除了写作的文笔技巧、语法运用的熟练程度、数据分析的真实可靠以外,整个临床研究过程的质量高低在最大程度上决定了医学论文的质量。
本文将从临床研究的层面,结合国际最新的发展趋势,多方位深入探讨临床医学研究体系发展道路上的关键点,为提高临床研究质量提供新的思路。
一、为试验质量设置高标准
“质量”在临床试验中的定义是“没有对决策有影响的错误发生”。在这里,“错误”指的是对受试者的安全或试验结果的可信度有重大影响的错误。近年来,临床试验转化计划(CTTI)提出Quality by Design(QbD)的建议。将“质量”融入科学的方案设计以及临床试验的实施过程之中。
1)鼓励运用批判性思维与开放式的对话方式,针对试验的特点找出能够提高该试验质量的关键因素。而不是用“一刀切”的方式将质量的把控完全依赖于某一固定的清单或一览表。
2)化冗为简,对试验设计进行严格评估,只保留对受试者安全或试验结果可信度必不可少的步骤,增加效率,将资源集中用于最关键的领域。
3)听取多方意见,尤其是直接参与受试者入组的临床研究者和临床协调员。他们的建议对入组速度、回访频率、试验终点等往往有着不可低估的价值,也是试验成功的关键。
二、实现移动端临床试验
随着移动科技的不断发展,远程医疗虽然已经逐渐被大众以及医疗保健提供者所接受,但是在临床试验中还并没有得到普及。其中不可避免地有法律、法规和实践方面的顾虑,但是不可否认在临床试验中适度地使用移动技术可以:
1)减轻受试者访视负担,提高回访成功率;
2)受试者不受门诊访视的时间限制,可以更加完整的获取问卷类信息;
3)在收集受试者自我评估报告数据的同时,对其健康行为进行系统精准地管理,避免治疗用药干预的延迟;
4)具有信息收集准确度更高、时效性更好、患者依从性更高、使用更便捷等优点。
目前CTTI正在努力解决移动端临床试验中面临的一些实际问题,比如说远程医疗国家/地区的许可问题、GCP在各地区执行情况等等,积极地去推进移动端技术在分散性临床试验(Decentralized Clinical Trial)中的应用。
三、推动采用sIRB加速审批流程
一直以来,多中心临床试验需要各中心所属机构IRB分别进行试验方案和知情同意书的审批,从而导致重复递交和冗长的审批流程。早在21世纪初期单一伦理审查委员会 (single IRB; sIRB)的概念已经被美国的监管机构所接受。2016年美国国家卫生研究院(NIH)推行了在NIH支持的多中心临床试验中使用sIRB的政策,该项政策在2018年1月正式实施。美国Final Common Rule法案要求从2020年1月20日起,所有接受联邦资金资助的、在美国境内参与合作性研究的本土机构都需要使用sIRB。
随着对sIRB理解的不断深入,sIRB有可以简化审批流程,提高多中心试验的质量和效率,减少研究启动时间和降低管理负担与成本的优点。但同时采用sIRB需要特别注意:
1)因多中心试验中各中心常有各自特殊要求,需提前确定各中心能否接受sIRB审查;
2)涉及各中心职责的互信协议的达成与签署往往会比较繁琐与耗时;
3)sIRB和区域伦理委员会是两个不同的概念,申请流程也有所不同。
四、提升受试者在试验中的参与度
基于以往的经验,即使试验方案设计科学,在很多情况下仍会因受试者无法深入了解研究药物、对试验没信心或是不认可,使得实际工作中遇到受试者筛选困难、依从性不高、评估困难等问题,导致试验时间、人力和物力的浪费。不仅如此,由于受试者在临床试验中的地位不平衡和获取信息的不对称,受试者常常处于被动地位。
在意识到了上述问题后,FDA参考欧洲药品管理局(EMA)的“病人和消费者工作组”的模式,联合CTTI在2018年成立了“患者参与协作小组”(Patient Engagement Collaborative;PEC)。目的是提高患者在医疗产品开发和上市药品监管讨论中的参与度。PEC的患者代表应具有直接或间接的疾病经验,包括有既往疾病史的患者和有护理经验的人员(护理人员可以是患者的父母、子女、伴侣或朋友等)。
PEC小组的讨论内容包括:
1)建立新的模式和体系,使患者以合作伙伴的形式参与到医疗产品开发和监管的过程中来;
2)促使患者的参与度更加系统化;
3)增加医疗产品开发和监管过程的透明度;
4)搭建FDA与患者群体之间的沟通工具;
5)开发针对患者群体的医疗产品监管流程的教育工具。
目前我国还没有相关指南,PEC模式对我国临床试验和医疗产品的开发和监管具有借鉴意义。

2016年美国通过的21世纪治疗法案中明确了RWD和RWE的地位和作用,并支持RWD和RWE用于监管决策的制定之中。
1)FDA目前已使用RWD和RWE对药品上市后的安全性和不良反应的发生进行监控,并将其作为制定监管决策的依据;
2)医疗团体和医务工作者可使用这些数据在临床实践中制定诊疗指南;
3)药厂或研究者可以以RWD和RWE为依据,设计出更加符合现实情况的研究方案。
获取RWD的途径多种多样,包括但不限于:电子健康记录、医疗索赔记录、家庭调查问卷、移动穿戴装置等等,具体如下图。
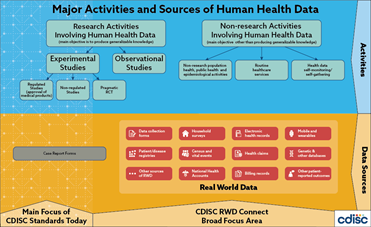
图片来源:https://www.cdisc.org/standards/real-world-data
结语:
总体来看,我国的临床研究在近十年来有了长足的发展,但是目前尚缺乏高质量、系统性的临床医学研究体系和临床规范的制定,与发达国家还具有一定的差距。未来,仍需要参考国际上的先进经验和发展趋势,进一步加强对临床医学研究领域的顶层设计,促进临床研究与基础研究的转化结合以及跨学科交叉融合,推动医学成果转化,助力实现健康中国战略。
参考资料:
1.https://www.fda.gov/science-research/science-and-research-special-topics/real-world-evidence
2.https://www.ctti-clinicaltrials.org/projects/decentralized-clinical-trials
3.Lidz CW, Pivovarova E, Appelbaum P, Stiles DF, Murray A, Klitzman RL. Reliance agreements and single IRB review of multisite research: Concerns of IRB members and staff. AJOB Empir Bioeth. 2018 Jul-Sep;9(3):164-172.
4.Wolinetz CD, Collins FS. Single-Minded Research Review: The Common Rule and Single IRB Policy. Am J Bioeth. 2017 Jul;17(7):34-36. doi: 10.1080/15265161.2017.1328542.
5.https://www.fda.gov/patients/learn-about-fda-patient-engagement/patient-engagement-collaborative