
往期回顾:
个体化细胞治疗技术国家地方联合工程实验室多年来深入研究分析GMP(药品生产质量管理规范)和GAMP5(良好自动化生产实践指南),结合自身丰富的细胞领域实验室成果,转化为细胞行业信息化解决方案,为研发、生产、临床端提供既满足业务需求,又符合法律法规的信息化软件,打造细胞全生命周期闭环管理,填补了国内生物医药行业细胞治疗产品的信息化短板。平台软件已在全国多家医院、综合细胞库、细胞公司、CRO公司等落地使用,极大提升了客户的工作效率,获得了客户认可。
实验室归纳总结了自身的细胞行业应用软件开发经验,从对GMP标准规范、GAMP5方法指南的解读,规范及指南如何运用到细胞行业应用软件的设计中,以及实验室依此打造出的细胞全生命周期管理平台各类行业应用软件介绍,分四大章节讲述。
参考文件:
NMPA 2010版 《药品生产质量管理规范》
NMPA 《GMP附录-细胞治疗产品》(征求意见稿)
NMPA 《GMP附录-计算机化系统》
ISPE 《GAMP5》
FDA 《21 CFR Part 11》(《联邦法规21章》第11款)

本章节讲述结合细胞行业特点,GMP规范要求,GAMP5方法指南,如何设计规划及管理,开发出既符合细胞行业用户的使用需求,又满足行业法律法规要求的应用软件。注:本文所述的计算机化系统,重点针对软件。
一个完整的生物医药行业应用软件,既要符合用户的使用需求,又要满足行业法律法规(GMP)的要求,功能设计就需要从这两个方面做考虑。
● 产品通用功能
产品通用功能,一般基于该行业,以及软件所承载的业务场景,通过行业调研、市场调研等活动,规划设计满足业务场景的基本业务操作流程,最终提炼成产品通用功能。如权限控制,统计查询,报告打印等。
● 用户定制化需求
根据所服务的客户/用户所在公司的特殊业务要求,做出适用的业务操作流程调整,称之为定制化需求。
定制化需求需要做好控制,严控需求蔓延,不破坏行业规则,否则会阻碍供应链上下游公司的信息化联通,加深行业内公司间的技术交流壁垒,同时也给软件版本维护带来极大的不便。
遵照GMP,及计算机化系统、细胞治疗产品附录要求,提炼出如下重点功能:
● 生产过程记录
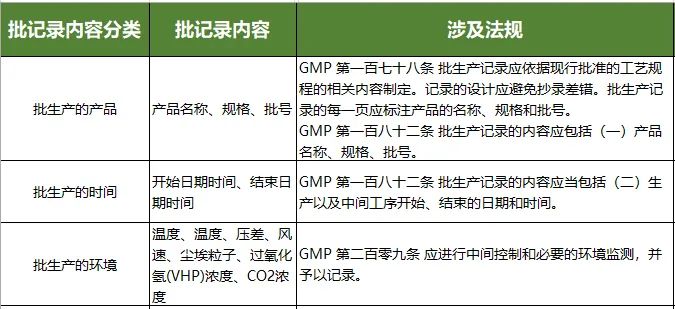
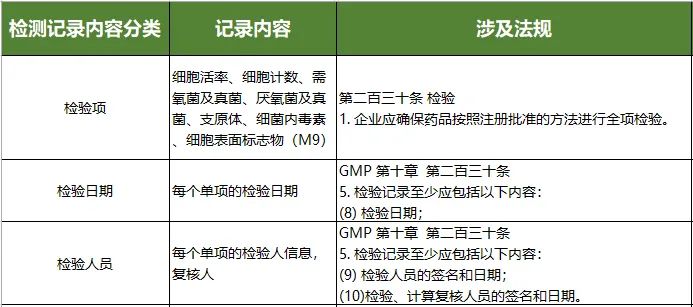
1) 建议对批生产记录,批包装记录,清场记录,检验记录,受权,复核,工艺规程等人机料法环内容进行记录,以作为产品追溯的重要依据。
生产过程记录,包括批生产记录和检验记录,是制备档案、检测档案的数据来源,每一条分类内容都有对应法规要求,如下图(部分示意):
批生产记录
检验记录
2) 标准制备档案(批生产记录)的内容框架建议
主要记录展示完整工序,实际操作的关键参数,操作人,复核人,确认人等信息,表格如下图:

● 变更记录
依据NMPA 《GMP附录-计算机化系统》
第十六条 计算机化系统应当记录输入或确认关键数据人员的身份。只有经授权人员,方可修改已输入的数据。每次修改已输入的关键数据均应当经过批准,并应当记录更改数据的理由。应当根据风险评估的结果,考虑在计算机化系统中建立数据审计跟踪系统,用于记录数据的输入和修改以及系统的使用和变更。
第十七条 计算机化系统的变更应当根据预定的操作规程进行,操作规程应当包括评估、验证、审核、批准和实施变更等规定。计算机化系统的变更,应经过该部分计算机化系统相关责任人员的同意,变更情况应有记录。
设计:
系统以及所有的数据,一旦通过验证,或者经过记录确认,原则上都不允许变动。若有变更(包括系统版本升级或者新增、修改、删除数据),必须在系统中记录操作人员账号、动作、时间、结果等关键信息。在此基础上,重点变更,如系统版本升级,细胞观察结果修改,必须要有复核、批准、变更理由等记录,以用于审计跟踪。
● 复核
依据NMPA 《GMP附录-计算机化系统》
第十五条 当人工输入关键数据时,应当复核输入记录以确保其准确性。这个复核可以由另外的操作人员完成,或采用经验证的电子方式。必要时,系统应当设置复核功能,确保数据输入的准确性和数据处理过程的正确性。
设计:
对重点数据的新增、修改、删除,系统版本升级等重点变更,应当设计复核、批准机制,复核、批准人员不能为操作人员本人,人员确认操作及结果无误后,通过系统确认,由系统生成电子签名并依附,以表示该操作确实由该人员操作,该人员确认此操作。
● 电子签名
依据NMPA 《GMP附录-计算机化系统》
第二十三条 电子数据可以采用电子签名的方式,电子签名应当遵循相应法律法规的要求。
依据FDA 《21 CFR Part 11》(《联邦法规21章》第11款)
分章 B 电子记录
11.50 签名的验证
11.70 签名/记录连接
分章 C 电子签名
11.100 一般要求
11.200 电子签名的构成及控制
11.300 识别代码和密码的控制
设计:
电子签名的主要作用有以下几点:
1、明确操作主体的身份,可识别其真实性;
2、表明操作主体认可操作的内容,一旦篡改可被发现;
3、整个操作过程会被记录,使用电子签名即对数据的完整性、正确性负责。
对系统判定的关键数据的操作,均需要操作人员电子签名标识,表示该操作确实由该人员操作,该人员确认此操作。
电子签名的实现技术有:
● 个人标识码记录——此方式最简单;
● 采用国家权威机构CA认证中心颁发的数字证书;
● 采用区块链技术,数据上链,利用哈希值固化;
● 时间戳技术,精确记录操作时间等信息。
● 电子记录保存年限
依据NMPA 2010版 《药品生产质量管理规范》
第一百六十八条 与本规范有关的每项活动均应有记录,所有记录至少应保存至药品有效期后一年,确认和验证、稳定性考察的记录和报告等重要文件应长期保存,以保证产品生产、质量控制和质量保证等活动可以追溯。
设计:
电子数据可存储在本地服务器或者云端,目前数据储存的技术和成本都已成熟稳定,如OSS对象存储,NAS共享文件存储,可以做到不受时空限制。
● 溯源
依据NMPA 2010版 《药品生产质量管理规范》
第一百七十七条 每批产品均应有相应的批生产记录,可追溯该批产品的生产历史以及与质量有关的情况。
第一百八十三条 每批产品或每批中部分产品的包装,都应有批包装记录,可追溯该批产品包装操作以及与质量有关的情况。
第二百二十八条 每批药品的检验记录应包括中间产品、待包装产品和成品的质量检验记录,可追溯该批药品所有相关的质量检验情况。
依据NMPA 《GMP附录-细胞治疗产品》(征求意见稿)
第四条 (五)【溯源】自体细胞治疗产品如发生混淆,对使用者将产生严重后果,确保产品从供体到受者全过程正确标识且可追溯尤其重要。
第四十一条【产品追溯系统】企业应当建立产品标识和追溯系统,确保产品在供体材料接收、运输、生产和使用全过程中,来源于不同供体的产品不会发生混淆、差错,且可以追溯。
该系统宜采用经验证的计算机化系统,应当可以实现对产品的双向追溯,包括从供体材料接收、运输、生产、检验和放行,直至成品运输和使用的全过程。
依据NMPA 《GMP附录-计算机化系统》
第二十四条 (五)数据审计跟踪:是一系列有关计算机操作系统、应用程序及用户操作等事件的记录,用以帮助从原始数据追踪到有关的记录、报告或事件,或从记录、报告、事件追溯到原始数据。
设计:
1、制定产品过程动态编码,成品唯一固定编码,通过批次号关联的编码规则;
2、确保产品在供体材料接收、运输、生产、检验、放行和成品运输和使用全过程中,都有信息记录,并通过唯一标识关联。

对于行业应用软件的开发管理,可从客户、产品、项目、研发过程、质量、团队、采购、文件、信息安全、软件维护等方面制定管理程序并严格执行,以契合GAMP的指导方法。
