细胞治疗技术已成为近年来最引人注目的领域之一,在癌症、血液疾病、心血管疾病、糖尿病和神经系统疾病等领域均展示出良好的治疗前景,尤其在肿瘤免疫治疗中发挥了重要作用,目前已有十余款免疫细胞疗法上市。随着全球各国政策的鼓励及基因编辑等创新技术的不断迭代创新,细胞治疗产品研发已进入快速发展阶段,大量候选产品进入临床研究。本文对细胞治疗产品的研发历程及市场进行简介。
细胞治疗(Cell therapy)是指通过输入在体外选择、操纵或改变的细胞来治疗或预防疾病。根据供体来源,细胞治疗可分为自体细胞治疗(来自于患者自身细胞)、异体细胞治疗(来自于第三方供体)、同基因细胞(基因相同的个体)和异种细胞(不同物种的细胞)。根据分化潜能,细胞疗法参与的细胞可分为干细胞和体细胞等,其中体细胞中的免疫细胞产品在临床多种疾病的治疗中表现出显著的效果,如CAR-T细胞疗法和TCR-T细胞疗法。美国FDA将细胞免疫疗法、癌症疫苗以及用于某些适应症治疗的其他类型的自体和异体细胞,包括造血干细胞和成体、胚胎干细胞纳入细胞治疗产品的监管。我国对细胞治疗产品的定义为人源的活细胞产品,包括经过或未经过基因修饰的细胞,如自体或异体的免疫细胞、干细胞、组织细胞或细胞系等产品,不包括输血用的血液成分、已有规定的移植用造血干细胞、生殖相关细胞,以及由细胞组成的组织、器官类产品等。
1968年,世界上第一例用于造血功能障碍的骨髓移植术完成,其有效成分是造血干细胞。1988年,人类胚胎干细胞在体外生长和增殖成功,同年,肿瘤浸润淋巴细胞(TIL)疗法首次在临床上用于转移性黑色素瘤治疗达到了60%的客观有效率(ORR)。1997年,FDA首次批准了自体软骨细胞疗法(Carticel)用于修复由急性或重复性创伤引起的症状性股骨髁软骨缺损;2010年,首个树突状细胞(Dendritic cell,DC)癌症疫苗Provenge用于治疗激素难治性前列腺癌获得FDA批准;2017年,过继性细胞疗法(Adoptive cell therapy,ACT)在肿瘤免疫治疗上取得了巨大成功,两款CAR-T产品Kymriah和Yescarta上市;2021年由复星凯特引进的Yescarta(阿基仑赛注射液)被国家药品监督管理局(NMPA)批准,成为国内首款上市的CAR-T产品,随后药明巨诺的瑞基奥仑赛也被批准,成为我国首款按1类生物制品获批的CAR-T产品以及我国第二款获准上市的CAR-T产品(图1)。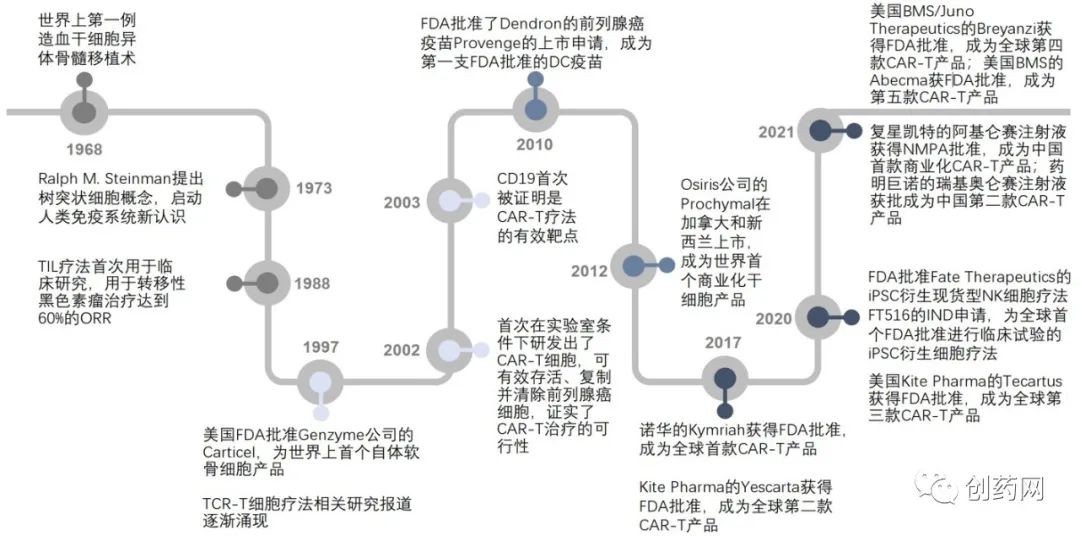
图1:细胞治疗发展历程
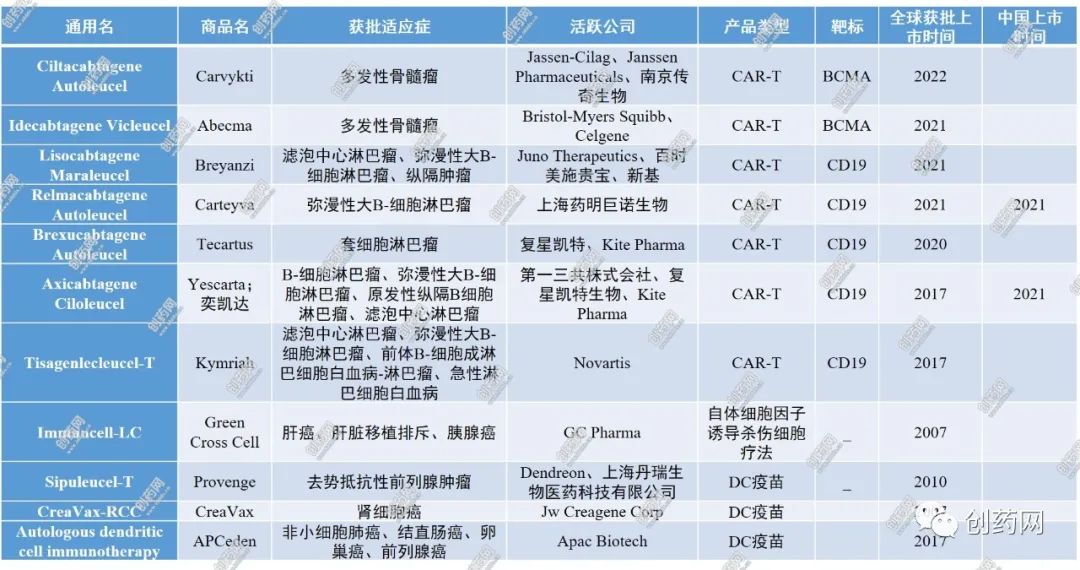
细胞治疗是生物医药产业的新兴技术,被各国列为重点支持领域。美国、欧盟、日本、韩国等国家和地区的药物监督管理部门相继出台了一系列法案,大力支持细胞治疗技术向临床应用的加速转化,以早日惠及患者。美国和欧盟主要根据药物监督思路进行管理,并依据细胞产品的风险分类设定其未来的上市通道。同时,美国专门出台了再生医学先进疗法通道(Regeneratrive Medicine Advanced Therapy Destination),加速干细胞治疗产品等的上市。目前,日本采用的是“双轨制”监督管理策略,低风险的诊疗技术由厚生劳动省批准,中风险或高风险的项目则由日本药品监督管理局按照药品监督管理方案进行审批。监督管理政策和市场需求加速了细胞治疗企业的发展,近十年来,全球细胞治疗市场持续增长。根据全球市场情报机构Fiormarkets报告显示,2017年全球细胞治疗产品市场约为112亿美元,2018年至2025年市场复合年增长率为16.8%,预计2025年市场将超过340亿美元。CAR-T疗法作为该领域的热点技术,为恶性血液肿瘤患者带来了希望,市场规模将持续稳定地增长,预计2025年市场将达90亿美元,其中美国占据市场一半的份额。我国CAR-T市场虽起步较晚,但增长势头迅猛,未来在肿瘤患者增加、政策优惠、患者负担能力提高的推动下,2025年市场预计将增加到11.5亿美元。目前,全球已上市的各类细胞治疗产品约有60款,涉及多种类型疾病的治疗,如癌症、肌肉骨骼疾病、皮肤疾病、心血管疾病与代谢性疾病等。这些已上市的产品中,有11款为免疫细胞治疗产品,涉及的免疫细胞为T细胞和DC细胞,其中T细胞产品为用于血液系统恶性肿瘤的CAR-T疗法(7款)和一款自体细胞因子诱导杀伤(CIK)细胞疗法(Immuncell-LC),而DC细胞产品为用于治疗实体肿瘤的疫苗(3款),详情见表1。表1:全球已上市的免疫细胞治疗产品
已上市的干细胞疗法有25款,均为成体干细胞,包括10款造血干细胞产品、13款间充质干细胞产品和2款角膜缘干细胞产品。如在加拿大和新西兰等地获得批准用于治疗儿童急性移植物抗宿主病的Prochymal,在韩国获批的用于治疗急性心梗的Cellgram、用于治疗克罗恩病并发症肛瘘的Cupistem,以及与骨修复相关的产品2款,分别为2010年在澳大利亚上市的MPC和2012年在韩国上市的Cartistem。欧盟EMA于2015年批准使用体外扩增的含有干细胞移植的自体角膜上皮细胞(商品名为Holoclar),用于治疗化学性眼烧伤后角膜上皮干细胞缺乏症,这在眼科和医学领域开创了先例。2020年,日本批准了Japan Tissue Engineering的同类别产品(表2)。然而,我国尚无干细胞治疗类产品上市。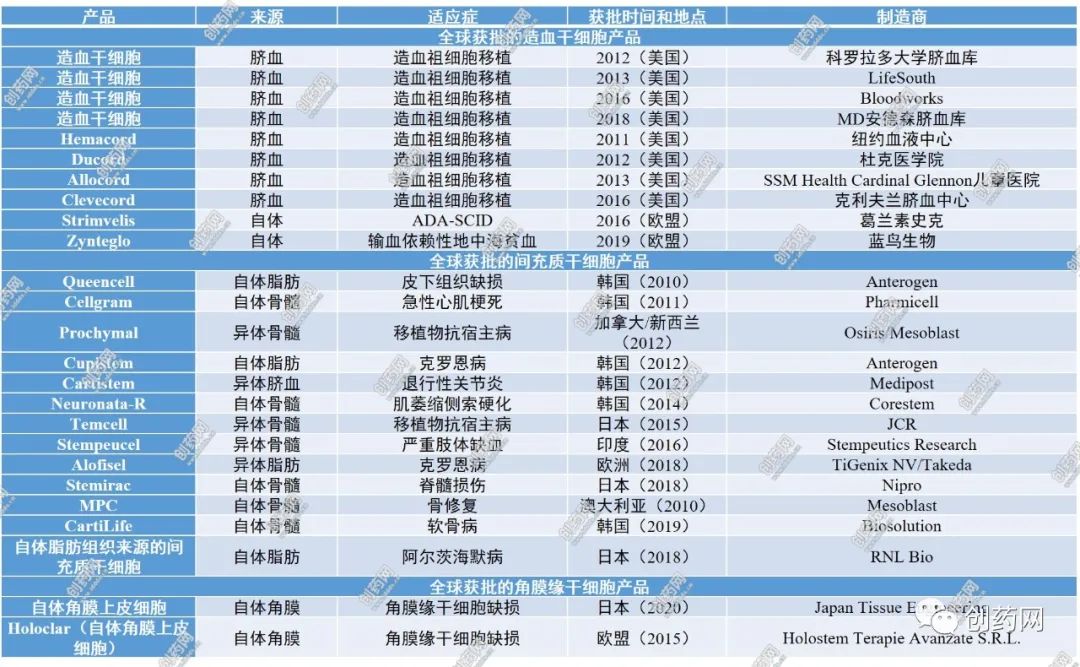
其他体细胞类产品,如体成纤维细胞产品LAVIV (Azficel-T), 自体膝软骨修复产品MACI (Autologous cultured chondrocytes on a porcine collagen membrane) 等已被FDA批准。1. Cell Therapy,https://www.sciencedirect.com/topics/neuroscience/cell-therapy.
2. 张宇. 细胞治疗技术: 下一代疾病治疗药物的方向. 张江科技评论, 2021(6): 32-34.
3. 沙利文. 中国细胞治疗产业发展白皮书, 2021年11月.
4. Pharmaprojects数据库, 检索日期: 2022年7月22日.
5. 药明康德、药渡、亿欧等网络公开资源.


